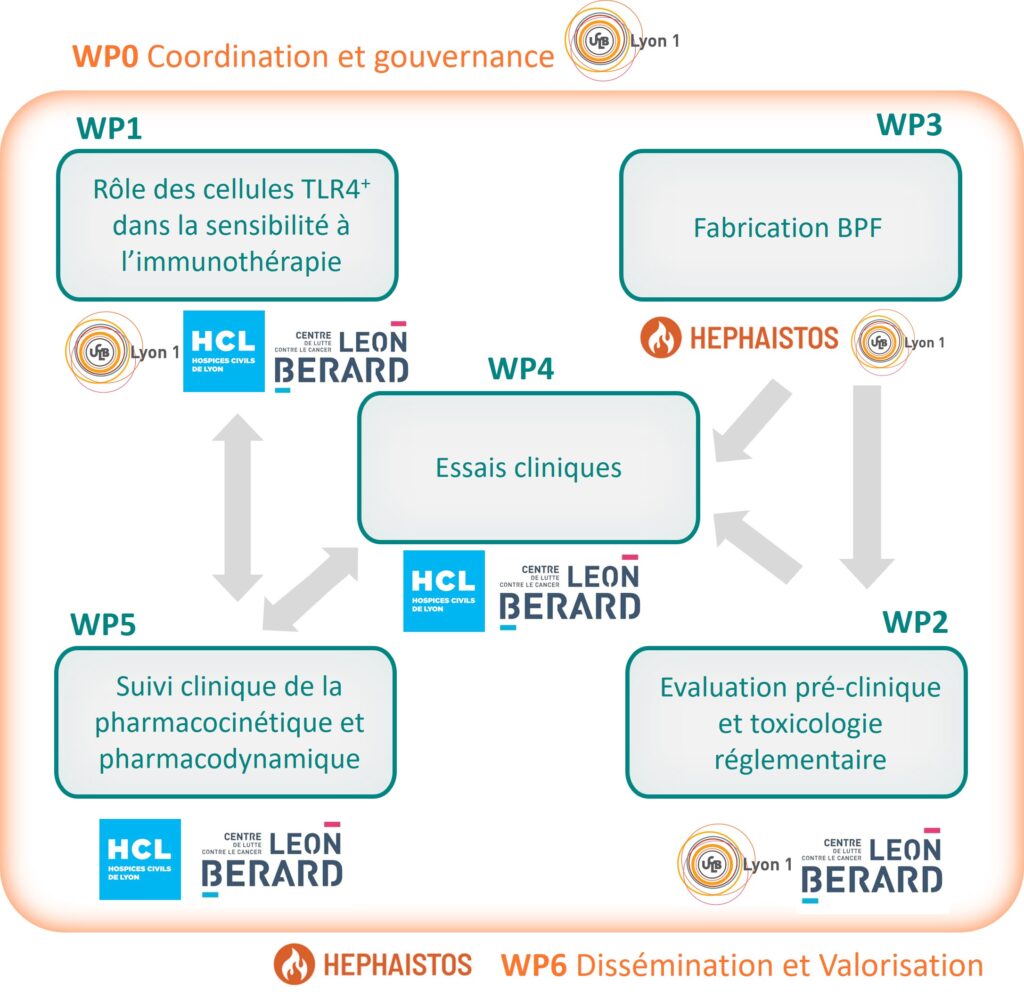
WP0
Coordination et gouvernance

Ce projet ambitieux mobilise de nombreuses parties prenantes. Pour assurer la circulation des informations au sein du consortium et répondre aux exigences des différents secteurs impliqués (universitaire, médical, financier, réglementaire, éthique), une gestion et une coordination rigoureuses s’imposent. Afin de garantir la meilleure orientation possible du projet SyStInn, sa gouvernance est confiée à la fois à un comité stratégique, un comité de pilotage et un comité scientifique international. Ce projet doit par ailleurs respecter les exigences et le calendrier établis par l’établissement financeur, l’ANR. Cela inclut notamment la remise de rapports scientifiques et financiers chaque année, l’organisation de réunions de suivi annuelles, l’élaboration d’un plan de gestions des données.
WP1
Rôle des cellules TLR4+ dans la sensibilité à l’immunothérapie

TLR4 est le récepteur d’HEPHA-440, principalement exprimé par certaines cellules du système immunitaire inné telles que les monocytes, macrophages et cellules dendritiques. Ce volet recherche a pour objectif d’élucider l’ensemble des mécanismes d’action d’HEPHA-440 à l’échelle moléculaire et cellulaire et de comprendre le rôle des cellules exprimant le récepteur TLR4 dans la réponse à l’immunothérapie. Alors que la mémoire immunitaire adaptative, qui permet aux lymphocytes de réagir de manière spécifique et rapide si un envahisseur se présente à nouveau, est bien connue et décrite, l’hypothèse d’une mémoire immunitaire innée émerge et sera explorée dans ce contexte.
WP2
Evaluation pré-clinique et toxicologie réglementaire

Cet axe vise à caractériser sur des modèles animaux (souris et lapins) l’efficacité antitumorale d’HEPHA-440 seul et en combinaison avec d’autres immunothérapies, ainsi que sa tolérabilité. L’étude de toxicologie réglementaire pré-clinique sera effectuée par une entreprise externe selon les « Bonnes Pratiques de Laboratoire » (BPL), afin de connaître le devenir du médicament dans l’organisme et de caractériser ses effets sur les différents organes. Elle est un élément clé pour que les agences de sécurité du médicament approuvent les premières administrations chez l’humain.
WP3
Fabrication selon les normes BPF

Cette phase, prise en charge par le partenaire industriel, a pour objectif de fabriquer les lots d’HEPHA-440 destinés à une utilisation clinique, en s’assurant de remplir un certain nombre de critères de qualité (pureté, reproductibilité des lots, etc.) conformément aux « Bonnes Pratiques de Fabrication » (BPF). La stabilité du composé sera par ailleurs évaluée afin de déterminer son conditionnement et sa durée d’utilisation. En vue d’une éventuelle mise sur le marché à l’issue du projet, il sera ensuite nécessaire de produire HEPHA-440 à grande échelle.
WP4
Essais cliniques

Les essais cliniques ont pour objectif d’étudier la sécurité et l’efficacité d’HEPHA-440 chez des personnes atteintes de cancers. Durant la phase I, le médicament sera injecté à des doses croissantes chez des adultes en phase terminale de cancers. L’ensemble de ses effets sur l’organisme seront investigués, ce qui permettra de déterminer une dose sécuritaire et efficace pour la phase II, appelée RP2D (Recommended Dose for Phase II trial). Deux essais de phase II seront ensuite réalisés. L’efficacité du médicament seul à la RP2D sera évaluée chez 18 patient·e·s atteint·e·s d’ostéosarcome, un cancer des os touchant principalement les enfants et adolescent·e·s. En parallèle, l’efficacité d’HEPHA-440 en combinaison avec d’autres immunothérapies (des « Inhibiteurs des points de contrôle immunitaires ») sera testée sur une cohorte de 25 patient·e·s atteint·e·s de divers cancers solides.
WP5
Suivi clinique de la pharmacocinétique et pharmacodynamique
Grâce à des échantillons de sang prélevés chez les patient·e·s inclus·es dans les essais cliniques, les effets biologiques d’HEPHA-440 seront étudiés. Un premier objectif sera d’élucider les mécanismes d’action, notamment sur le système immunitaire, d’HEPHA-440 (pharmacodynamique). Un autre aspect consistera à caractériser la distribution d’HEPHA-440 dans l’organisme (pharmacocinétique). L’analyse statistique des différentes données cliniques permettra de définir des marqueurs d’efficacité, dont l’objectif final est de pouvoir identifier les patient∙e∙s susceptibles de répondre au traitement.
WP6
Dissémination et valorisation

Tout au long du projet, une réflexion sera menée avec l’ensemble du consortium à propos de la gestion de la propriété intellectuelle des résultats obtenus. Ils pourront être gardés confidentiels, diffusés, protégés par un brevet ou transférés à des tiers. Les résultats que nous déciderons de diffuser seront partagés via des mises à jour régulières du site Web, publiés dans des revues scientifiques internationales et présentés lors de congrès. Par ailleurs, les données obtenues lors des essais cliniques seront disponibles sur le site clinicaltrials.gov. Enfin, si les données cliniques confirment la sécurité et l’efficacité du traitement, les démarches pour sa mise sur le marché seront engagées.